بحث عن قوانين الغازات في الكيمياء
مقدمة بحث عن قوانين الغازات في الكيمياء
ومن أبسط حالات المادة هي حالى الغاز فهي أبسط من الحالة السائلة والحالة الصلبة، وتتميز الغازات بأنها حرة الحركة تتحرك بصورة عشوائية ومستمرة.
ومن الممكن أن تتحكم في سلوك الغازات عن طريق التحكم في درجة الحرارة والضغط الجوي، وتسمى هذه القوانين التي تصف هذه الحالة قوانين الغازات.
وتعتبر هذه القوانين قوانين متعلقة بالرياضيات، والتي توضح التأثير الناتج عن الغازات الخارجية عند تعرضها للضغط والحرارة، فمثلاً عند رفع درجة حرارة الغاز و تعرضه لضغط ثابت فإن حجمه يزداد، وبالعكس عندما نقلل درجة حرارة الغاز فإن حجمه يقل، وسوف نعرض فيما يلي لقوانين الغازات.
شاهد ايضًا : بحث كامل عن الحرارة النوعية
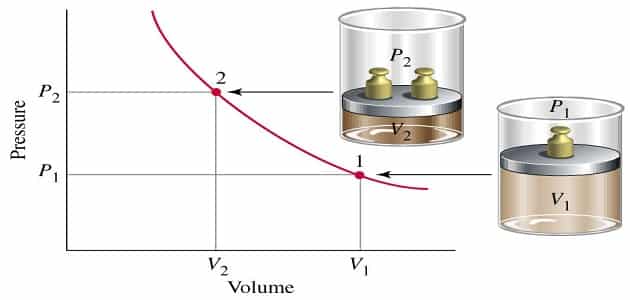
العلاقة بين الضغط والحجم (قانون بويل) : The Pressure-Volume Relationship: Boyle
قانون بويل
يتناسب حجم كمية معينة من أي غاز تناسبًا عكسيًا مع الضغط عند ثبوت درجة الحرارة.
مع العلم أن : حيث V هو حجم كتلة معينة من الغاز و P الضغط المؤثر على الغاز و k ثابت تعتمد على قيمة و كتلة الغاز ودرجة الحرارة
وذلك عند مضاعفة الضغط، فإن الحجم يتغير بشكل كبير لكمية معينة من الغاز ثبوت درجة الحرارة حيث V1و V2 الحجوم عند ضغط P1 وP2 .
شاهد ايضًا : بحث عن الإختراعات الحديثة التى أفادت البشرية
العلاقة بين درجة الحرارة والحجم (قانون شارلز ولوساك)
قانون شارل
ينص قانون شارل على أنه يتناسب حجم كمية معينة من غاز ما تناسبا طرديًا مع درجة حرارته المطلقة تحت ضغط ثابت.
V1/T1 = V2/T2 OR V1/V2 = T1/T2
إذا أطيع قانون شارل بدقة، فإن الغازات لن تتكثف عندما تبرد، ذلك يعني أن الغازات تتصرف بشكل مثالي عند درجات حرارة عالية و ضغوط منخفضة نسبيا فقط.
ثابت = V / T أو T ∝ V
ثابت V1 / T1 = V2 / T2 =
لا يوجد غاز تصل درجة حرارته قريبا من -273.15 ºC، حتى يتحول إلى سائل ثم جسم صلب.
وفي عام 1848 اوضح العلم لورد كلفن ان درجة الحرارة 273.15 درجة مئوية هي أقل درجات الحرارة المعروفة، وأطلق عليها درجة الصفر المطلق وهي علاقة بين درجة الحرارة وحجم الغاز.
حيث في مقياس كلفن لا توجد قيم سالبة ودرجة الصفر المطلق تمثل أقل درجة ممكنة لدرجة الحرارة.
العلاقة الجامعة بين قانون بويل وشارل
قانون بويل V ∝ 1/P
قاون شارل V ∝ T
ثابت PV/T
ثابت = P1 V1 / T1 = P2 V2 / T2
العالم الإيطالي أفوجادرو وجد في عام 1811 أنه عند ثبوت الضغط ودرجة الحرارة فإن الحجوم المتساوية من الغازات المختلفة تحتوي على نفس العدد من الجزيئات أو الذرات في حالة الغازات أحادية الذرة، وهذا يعني أن حجم الغاز يجب أن يعتمد عدد جزيئاته.
الحجوم المتساوية من الغازات المختلفة تحتوي على نفس العدد من الجزيئات عند قياسها تحت نفس الظروف من الضغط ودرجة الحرارة، حجم الغاز يتناسب طردا مع كمية الغاز عند ثبوت درجة الحرارة والضغط.
ثابت V / n = أو n ∝ V
ثابت V1 / n1 = V2 / n2 =
وبالمثل فإن ضغط الغاز يتناسب طرديا مع كميته عند ثبوت حجمه ودرجة الحرارة
(V/n=k)
– قد يرمز الرمز V على أنه حجم الغاز المضغوط.
– يرمز الحرف N على أنه عدد المولات الموجودة في الغاز.
– يرمز حرف K على أنه نسبة قبات الغاز.
K4= RT/P
معادلة الحالة للغاز المثالي : وتسمى القانون العام للغازات
الزيادة في كمية الغاز تؤدي إلى :
1- زيادة الحجم ( V ∝ n )
2- زيادة الضغط P) ∝n )
3 -انخفاض درجة الحرارة 1/ T) * (n قيمة الكسر PV/T يتناسب طرديا مع قيمة n
n ∝ PV/T أو x n ثابت= PV / T
T x n x ثابت PV =
P V = R n T
يرمز الحرف N إلى عدد المولات الموجودة في الغاز.
يرمز الحرف R معدل ثبات الغاز العام، وهو 0.0821 لتر
ويرمز حرف T على أنه درجة حرارة الغاز بالكلفن.
إن الغازات المثالية الفرضية فقط هي التي تمتثل تماما للنص الرياضـي القانــون الغاز المثالي ، و هذا النص يطلق عليه أيضًا معادلة الحالة لغاز مثالي.
و ذلك لأنها تربط بين تلك المتغيرات ) P,V,n,T ( التي تحدد الخواص الفيزيائية للغاز، و جزيئات الغازات المثالية لا يوجد رابط بينها و ليس لها حجم فعــل ذلك فهي نقاط مجردة.
وعندما يقترب غاز حقيقي كثيراً من الامتثال لقانون الغاز المثالي يقال بأن تصرفه مثالي، و بالتالي يمكن استعمال قانون الغاز المثالي لوصف تصرفها بدقة معقولة.
قانون دالتون للضغوط الجزيئية
الضغط الممارس من قبل كل غاز في المزيج يدعى الضغط الجزيئي، و الضغط الكلي يساوي مجموع الضغوط الجزئية لكل غاز في المزيـد، و بالإمكان التعبير عن هذه العبارة المعروفة بـ قانون دالتون للضغوط الجزيئية بالمعادلة التالية :
PT = Pa + Pb + Pc + ……..
و عندما يجمع الغاز المحضر في المختبر عن طريق إزاحة الماء ، فإنه يصبح “ملوثاً” بجزيئات الماء التي تتبخر إلى داخل الغاز، و بالتالي يساهم ضغط بخار المــاء في الضغط الكلي للغاز الرطب، و هكذا نستطيع أن نكتب :
PT=Pgas+PH2O
النظرية الحركية للغازات
الفروض
- تتألف الغازات من جسيمات دقيقة تسمى جزيئات تسير بسرعات متباينة ومستمرة وفي كل الاتجاهات، ولها كتلة وحجم معين يختلفان من غاز لآخر.
- تصطدم هذه الجسيمات ببعضها البعض وبجدار الإناء الموجودة فيه اصطداما مرناً مؤدياً إلى عدم فقدها طاقتها الحركية.
- معدل الطاقة الحركية لجميع الجزيئات يتناسب تناسبا طرديا مع درجة الحرارة المطلقة، وتبقى كمية هذه الطاقة ثابتة عند درجة حرارة معينة.
- قوى التجاذب بين هذه الجزيئات في غاية الصغر يمكن إهمالها.
- حجم الجسيمات صغيرة جدا بالمقارنة مع حجم الإناء وحجم المسافة بين الجزيئات وبالتالي يمكن إهمال حجومها.
- هذه الفروض تتحقق بالتمام فيما يسمى الغاز المثالي أو التام.
شاهد ايضًا : بحث كامل عن الوقت وأهميته في حياة الإنسان
خاتمة بحث عن قوانين الغازات في الكيمياء
وفي النهاية فإن هذه القوانين تستخدم في علم الديناميكا الحرارية، وذلك لحساب العديد من تطبيقات الكيمياء في الحياة اليومية.
