أضرار غاز الأمونيا
أضرار غاز الأمونيا غاز قلوي يعرف باسم النشادر أو الأمونياك عديم اللون وذو رائحة نفاذة تسبب تهيج في الجهاز التنفسي والعين.
يوجد في الحالة الغازية إلا أنه يمكن تحويله إلى الحالة السائلة بتعريضه للضغط بنسبة معينة غير قابل للاشتعال لكنه قد ينفجر إذا تعرضت الحاوية التي تحويه ل ضغط شديد.
تركيب الأمونيا الكيمائي
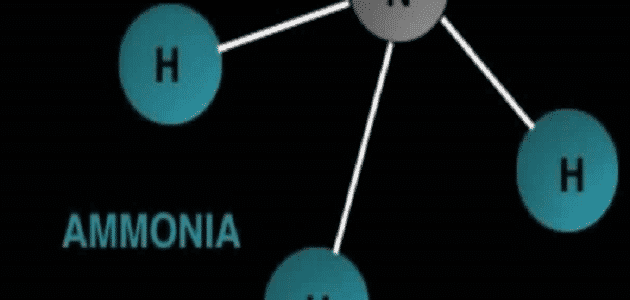
يتكون الأمونيا نتيجة اتحاد ذرة نيتروجين مع ثلاث ذرات هيدروجين ويعبر عنه بالرمز الكيميائي NH3.
خواص غاز الأمونيا
- ذو رائحة نفاذة.
- شديد الذوبان في الماء مكوناً محلول هيدروكسيد الأمونيا NH4OH وتتناسب هذه الخاصية عكسياً مع درجة الحرارة حيث يقل ذوبان الغاز بارتفاع درجة الحرارة.
- غاز قلوي التأثير يحول ورقة عباد الشمس إلى اللون الأزرق.
- أخف من الهواء.
- غاز سام يسبب تهيج لبعض أجزاء الجسم كالبلعوم والعين والأغشية المخاطية المبطنة للأنف.
- غاز عديم اللون.
- غير قابل للاشتعال ولكنه قد يتعرض حاويات الأمونيا للانفجار إذا تعرضت لارتفاع في درجات الحرارة.
- ينصهر عند درجة -77.73 درجة مئوية ويغلي عند درجة-33.34 درجة مئوية ويتحول إلى مادة سائلة عند درجة-33.35درجة مئوية ودرجة غليانه -33.35درجة مئوية أيضاً ويتحول إلى الحالة الصلبة عند درجة حرارة -77.7درجة مئوية.
- يتحول من الحالة السائلة إلى الحالة الغازية عن طريق امتصاص درجات حرارة عالية.
- له ثابت تأين يعادل 8×10-5.
شاهد أيضًا : ما هو الغاز المستخدم للطبخ
طرق تحضير غاز النشادر
هناك عدة طرق لتحضير غاز النشادر حيث يتم تحضيره داخل المختبر، وتحضيره للصناعة ومن أهمها:
تحضيره في المختبر
- نحصل على الأمونيا عند تفاعل أحد الأملاح التي تحتوي على أيون الأمونيوم مع أي قاعدة مثل هيدروكسيد الصوديوم أو هيدروكسيد الكالسيوم.
x2NH4Cl + Ca (OH) 2 ——> CaCl2 + x2NH3 +2H2O
تحضيره في الصناعة
يتم تحضير الأمونيا صناعياً بطريقتين:
- طريقة السياناميد.
- التفاعل المباشر بين النيتروجين والهيدروجين (تفاعل هابر).
طريقة السياناميد
نحصل على الأمونيا من خلال هذه الطريقة عبر خطوتين:
- الخطوة الأولى: سحق وتسخين كربيد الكالسيوم cac2 عند درجة حرارة 1100 درجة مئوية، وتفاعله مع غاز النيتروجين.
- ويتم ذلك عن طريق تمرير غاز النيتروجين خلال قضبان من الكربون موضوعة في حاويات تم توصيلها بتيار كهربائي، فنحصل على سياناميد الكالسيوم والجرافيت (أحد أشكال الكربون) وذلك وفق المعادلة الآتية:
CaC2 +N2 ——> CaCN2 + C
- الخطوة الثانية: يتم تفاعل بينساناميد الكالسيوم بتسخينه مع الماء تحت ضغط عالي فيتكون الأمونيا كربونات الكالسيوم وذلك وفق للمعادلة الآتية:
CaCN2 + 3H2O ——-> CaCO3 + 2NH3
(تفاعل هابر) التفاعل المباشر بين النيتروجين والهيدروجين:
- في عام 1913 حصل العالم الألماني فريتس هابر Fritz Haber لأنه استطاع تحضير غاز الأمونيا داخل معمله من تفاعل النيتروجين مع الهيدروجين ، وعلى الرغم هذا التفاعل يحتاج إلى تحضيرات خاصة.
- إلا أن هابر استطاع خلق أجواء مخبرية ملائمة برفع كلاً من الضغط الجوي والحرارة ليتم التفاعل داخل معمله.
- وبالفعل عام 1908 نجح في الحصول على الأمونيا من جهاز مبسط تم فيه التفاعل المباشر بين الهيدروجين والنيتروجين عند 300 درجة ضغط جوي وعند درجة حرارة 475 درجة مئوية وذلك في وجود أكسيد الألمونيوم كعامل مساعد محفز للتفاعل وتم التفاعل وفقًا للمعادلة الآتية:
N2 + 3 H2 = 2 NH3
- وبعدها استطاع الكيميائي كارل بوش تطوير جهاز هابر لكي يلائم الحجم الصناعي ويعد هذا التفاعل الأهم صناعيًا.
شاهد أيضًا : لماذا يستخدم غاز الهيليوم في المناطيد
أضرار غاز الأمونيا
- الأمونيا رائحة نفاذة تتسبب في التهاب وتهيج في الجهاز التنفسي وبعض من أجزاء الجسم كالعين والبلعوم، إذا تم استنشاقه مركزاً قد يؤدي إلى الوفاة.
- إذا تم ابتلاعه عن طريق الخطأ يتسبب في حروق شديدة في الفم وأجزاء مختلفة من الجسم كالفم والمريء، مصاحب بالآلام شديدة بمنطقة البطن مع قيء مستمر نتيجة ثقب في المعدة أو المريء.
- يدخل الأمونيا في صناعة بعض مستحضرات التجميل مثل كريمات البشرة وصبغات الشعر، ولكن هذه المستحضرات تؤدي إلى الكثير من الأضرار للبشرة وللشعر لذا ينصح بتجنب استعمالها.
الفرق بين غاز الأمونيا وأبخرة الأمونيا
- تختلف أبخرة الأمونيا عن غاز الأمونيا بأنها ثقيلة فلا تتصاعد لأعلى لثقلها عن الهواء، لذا تبقى قريبة من سطح الأرض مسببة زيادة الاختناق بغاز الأمونيا، لذا أبخرة الأمونيا تعد أكثر خطورة من الغاز.
إجراءات التعرض لغاز الأمونيا
- لتجنب الاختناق في حالة التعرض للتسمم من الغاز يجب الابتعاد عن مكان تسرب الغاز والانتقال إلى مكان ذو هواء نقي، التخلص من الملابس التي تعرضت للغاز لتجنب الإصابة بالحروق مع مراعاة تجنب ملامسة الملابس للوجه حتى لا يتعرض للحروق.
أهمية غاز الأمونيا
يعد لغاز الأمونيا أهمية في الطبيعة وفي داخل جسم الإنسان:
- فالأمونيا يدخل في تركيب البروتين الموجود بالجسم.
- كما أنه يوجد في الطبيعة في التربة بواسطة بعض أنواع البكتريا وأيضًا يوجد في مخلفات الحيوانات كما يتكون داخل أجسام الحيوانات وأجزاء بعض النباتات.
- يدخل في صناعة صبغات الأنسجة المستخدمة في صناعة الملابس.
- له دور في بعض الصناعات البلاستيكية.
- يدخل في صناعة الأدوية والفيتامينات.
- يستخدم في صناعة الأسمدة لزيادة الإنتاج الزراعي.
- استخدم قديماً في التبريد ولكن استبدل بغاز الفريون.
- يتم استعماله بعد أكسدته لصناعة حمض النيتريك الذي يدخل في العديد من الصناعات.
- يستخدم في تنظيف القطن والصوف.
- يستخدم في تنظيف بقع الأحماض.
- ويستخدم في صناعة المواد القاصمة (المتفجرات).
- يستخدم في صنع السبائك.
- ويستخدم في صنع المطاط.
- يستخدم في صناعة المبيدات الحشرية والمنظفات المنزلية.
- يستخدم في معالجة الصرف الصحي والنفايات.
خواص الأمونيا الكيميائية
- يتميز بثباته في الظروف العادية ولكن عند تعرضه للتيار الكهربائي يتم تحلله إلى العناصر المكونة له تحت ضغط عالي.
- لا يشتعل في الهواء ولكن ينفجر عند مزجه بالأوكسجين.
يدخل في تشكيل روابط تساندية وذلك لوجود شفع إلكتروني (ثنائية الإلكترونية) حرة كما في المثال التالي:
- حيث نجد أن غاز الأمونيا اتحد مع أيون الهيدروجين مكوناً أيون الأمونيوم.
- يرتبط الأمونيا مع ايونات المعادن الانتقالية وذلك لوجود شفع إلكتروني أيضًا.
- يعمل النشادر كعامل مختزل حيث يقوم اختزال الأوكسجين من أكاسيد المعادن بنزع الأوكسجين.
- يمكن إحلال عنصر أخر مكان ذرة الهيدروجين في جزئ النشادر.
تفاعل غاز الأمونيا مع الغازات
- يتفاعل الأمونيا مع الغازات المختلفة وعلى سبيل المثال عندما يتفاعل النشادر مع غاز الكلور Cl2 ينتج غاز النيتروجين N2.
- كما يتفاعل مع غاز الأوكسجين ويكون ناتج التفاعل يعتمد على ظروف التفاعل نفسه، فعند تفاعل غاز النشادر مع الأكسجين مع التسخين ينتج غاز الآزوت، أما عند تفاعله مع الأكسجين مع التسخين ووجود عامل محفز مثل البلاتين يتحول أكسيد الآزوت NO.
شاهد أيضًا : ما هو غاز البروبان ومخاطرة
تكلمنا اليوم معكم عن أضرار غاز الأمونيا وذكرنا أن غاز الأمونيا غاز قلوي يعرف باسم النشادر أو الأمونيا عديم اللون.
وذو رائحة نفاذة تسبب تهيج في الجهاز التنفسي والعين، نرجو أن تكون المعلومات قد أفادتكم، لا تنسوا لايك وشير للمقال لتعم الفائدة على الجميع.
